Что такое таргетная терапия
Для лекарственной терапии рака используют химиотерапию, гормональную терапию, иммунотерапию и таргетные препараты.
Название «таргетная терапия» происходит от английского слова target, что означает «мишень». Принцип действия этих препаратов действительно можно сравнить с прицельным выстрелом. Они взаимодействуют с раковыми клетками, у которых есть особые белковые молекулы или мутировавшие гены, не свойственные здоровым клеткам. Связываясь с этими молекулами-мишенями, таргетные препараты заставляют раковые клетки умирать, замедляют их распространение или останавливают рост кровеносных сосудов, питающих опухоль.
Таргетные препараты переносятся лучше, чем, например, химиотерапия, которая одинаково пагубно влияет на все быстро делящиеся клетки, не разбирая, нормальные они или злокачественные. Тем не менее таргетная терапия всё равно отражается на функционировании организма, поэтому у 90% пациентов развиваются побочные эффекты, но они не такие тяжёлые, как последствия химиотерапии. Чаще всего возникают сыпь на коже и слизистых оболочках, диарея, повышается давление, ухудшается состояние волос и ногтей.

Многие таргетные препараты выпускают в виде таблеток, так что для лечения не нужно регулярно посещать медучреждение
Первые таргетные препараты появились в начале 1990-х годов. Сегодня в мировой онкопрактике используется более 30 препаратов таргетной направленности. Такую терапию применяют для лечения разных видов онкологических заболеваний: меланомы, рака лёгкого, желудка, молочной железы, кишечника. Однако препараты подходят не всем пациентам, а только тем, у кого в клетках опухоли есть специфические мишени (белки или генетические мутации). Чтобы определить,можно ли применять этот вид лечения, врач назначает молекулярно-генетическое тестирование раковых клеток.
Таргетные препараты применяют как по отдельности, так и в комбинации с другими методами — химиотерапией, лучевой терапией, хирургическими операциями.
и делаем скидки до 30%
Начните экономить прямо сейчас!
История лекарственной терапии рака
До XX века эффективной лекарственной терапии рака не существовало. Онкологические заболевания безуспешно пытались лечить с помощью трав, ядов, минералов. Единственным действенным инструментом онколога тогда был хирургический скальпель. С конца XIX века, после изобретения рентгеновских лучей, начали проводить эксперименты, которые положили начало лучевой терапии — лечению с помощью ионизирующего излучения. Этот метод успешно используется до сих пор.
Химиотерапия рака начала применяться в середине прошлого столетия. В конце 40-х годов были разработаны антифолаты — первые из химиотерапевтических препаратов. В 1948 году американский учёный Сидни Фарбер смог с помощью химиотерапии добиться ремиссии у детей с лейкозом.
Химиотерапия появилась больше 70 лет назад
Параллельно с конца XIX века велись исследования влияния гормонов на развитие онкологических заболеваний. Гормоны способствуют росту некоторых злокачественных новообразований молочной железы, матки, простаты, надпочечников. С первой половины XX века разрабатываются и применяются препараты, которые контролируют или прекращают выработку гормонов. Благодаря этому рост и развитие опухолей замедляется или останавливается.
В начале 50-х годов прошлого века американский генетик Герман Джозеф Меллер предположил, что за злокачественную трансформацию клеток отвечают мутации, а в начале 70-х годов его соотечественник Альфред Джордж Кнудсон предложил мутационную теорию онкогенеза. Он доказал, что злокачественные опухоли возникают из-за поломок в клеточном геноме. Это открытие позволило начать разработку новых методов борьбы с онкологическими заболеваниями, одним из которых и стала таргетная терапия.

Альфред Джордж Кнудсон сделал большой шаг в определении генетической природы опухолей
С этого времени велась работа над созданием препаратов, которые воздействуют на раковые клетки, содержащие белки-мишени, и иммунопрепаратов, которые помогают собственным иммунным клеткам пациента распознавать раковую опухоль и уничтожать её. Первые таргетные препараты — ритуксимаб и трастузумаб — выпустили в конце 1990-х годов.
Принцип действия таргетной терапии
Причина развития любой раковой опухоли — генетические мутации. В процессе естественного деления клеток регулярно происходят изменения в генах. Чаще всего такую «неудачную» клетку уничтожает иммунная система, но иногда они выживают. Изменившиеся гены начинают по-другому кодировать белковые структуры, которые регулируют рост и деление клеток, а также репарацию (починку) сломанной ДНК.
При некоторых видах рака на поверхности злокачественных клеток и внутри них появляются белковые молекулы, которые приказывают клетке делиться и тормозят её естественную гибель. Их называют опухолевыми антигенами. На здоровых клетках такие белковые молекулы образуются в значительно меньшем количестве или отсутствуют вовсе.
Именно эти белки и мутации в генах становятся мишенями для таргетных препаратов. Например, одной из первых мишеней, для которой был разработан таргетный препарат, стал рецептор эпидермального фактора роста, тип 2, — белок, присутствующий на мембранах клеток. Он кодируется геном HER2. На поверхности здоровых клеток содержится около 20 тыс. таких рецепторов. При мутации гена HER2 их количество вырастает до 2 млн. Мутация гена HER2 обнаруживается у 15–30% пациенток с раком молочной железы.
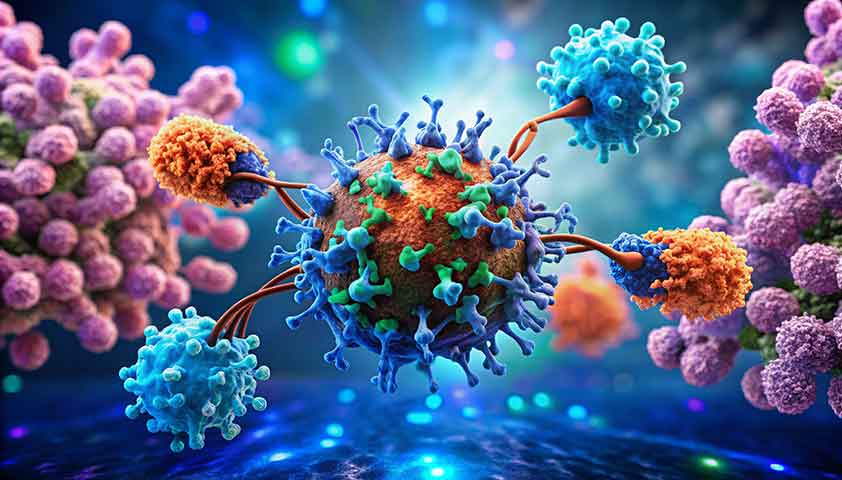
Молекулы таргетного препарата связываются с рецепторами HER2, которые расположены на поверхности раковой клетки
Таргетные препараты могут воздействовать на раковые клетки разными способами:
- разрушать клетки изнутри. Таргетный препарат проникает внутрь раковой клетки и разрушает её органеллы (постоянные компоненты клетки, её «внутренние органы»), в результате чего она погибает;
- подавлять рост сосудов. Стремительно растущей раковой опухоли необходимо кровоснабжение, поэтому она провоцирует рост кровеносных сосудов. Таргетный препарат угнетает этот процесс, лишая новообразование необходимого питания;
- блокировать сигналы, которые заставляют раковую клетку расти и делиться. Лекарства нарушают каскад реакций, которые способствуют бесконтрольному размножению клеток;
- активировать иммунную систему. Опухолевые клетки разными способами скрываются или обманывают иммунную систему. Препараты помогают её активировать, чтобы организм начал сам уничтожать раковые клетки. В одних медицинских источниках препараты с таким механизмом действия относят к таргетной терапии, в других — к иммунотерапии.
Виды таргетных препаратов
Таргетные лекарства делятся на два основных класса. Первый — это низкомолекулярные препараты. Они содержат малые молекулы, которые нацеливаются на белки, находящиеся внутри клетки. Такие молекулы проникают через мембрану раковых клеток и действуют изнутри. Обычно они представлены в виде таблеток или капсул, которые принимаются перорально.
Второй класс — это крупномолекулярные препараты, которые связываются с белками-рецепторами, расположенными на поверхности клеток. Такие лекарственные средства вводятся внутривенно или подкожно.
Также таргетные препараты классифицируют в зависимости от механизма действия:
- ингибиторы ангиогенеза — препятствуют образованию кровеносных сосудов в опухоли;
- моноклональные антитела — доставляют к раковой клетке радиоактивное или токсичное химическое вещество, которое уничтожает её, проникая сквозь мембрану. Другие виды моноклональных антител связываются с иммунными клетками, помогая им распознавать и уничтожать раковую опухоль. Их можно отнести к иммунотерапии;
- ингибиторы протеасом — нарушают нормальную работу раковых клеток, в результате чего они погибают;
- ингибиторы сигнальной трансдукции — нарушают передачу сигналов, под воздействием которых клетка безостановочно делится;
- индукторы апоптоза — стимулируют процесс естественной гибели, который у раковых клеток отключён.
Преимущества таргетной терапии
Таргетная терапия эффективна в лечении опухолей, которые нечувствительны к химиотерапии. Даже на последней стадии рака таргетные препараты предотвращают развитие новых раковых клеток и метастазов. Они позволяют задержать развитие болезни и выиграть для пациента месяцы, а иногда и годы жизни.
Таргетная терапия менее токсична, чем химиотерапия. У неё есть побочные эффекты, но, как правило, они переносятся пациентами легче. Кроме того, такие препараты удобнее применять. Если они выпускаются в форме таблеток, пациент может лечиться амбулаторно. Внутривенное введение препаратов проводится в медучреждении, но занимает меньше времени, чем капельница с препаратами для химиотерапии.
Этот вид лечения хорошо комбинируется с другими методами — хирургическим вмешательством, лучевой терапией и химиотерапией, усиливая их эффект.
Кому подходит таргетная терапия. Лабораторные исследования
Таргетная терапия подходит не всем пациентам. Для того чтобы препарат подействовал, в клетках опухоли должны быть мишени, которые встречаются далеко не при каждом случае онкологического заболевания. Чтобы выявить молекулярные нарушения, которые могут стать целью для таргетных препаратов, назначают молекулярно-генетические исследования. Материалом для них служит биопсийный или операционный материал — образец опухоли, который взяли во время обследования или хирургического вмешательства.

Перед назначением таргетной терапии необходимо тщательно исследовать биопсийный материал
Для выявления мишеней для таргетной терапии используют разные способы лабораторной диагностики. Первый из них — иммуногистохимическое исследование. Образец опухоли обрабатывают раствором специальных препаратов, которые вступают в реакцию с опухолевыми антигенами. Участки ткани, в которых произошла реакция, излучают свечение различной интенсивности, в результате получается цифровое изображение. С его помощью оценивают молекулярный подтип опухоли и определяют, к какому виду терапии она будет чувствительна.
Генетические мутации, которые привели к образованию белков-мишеней, позволяет выявить флуоресцентная гибридизация in situ (FISH — fluorescence in situ hybridization).
Также определить генетические мутации и узнать, будет ли рак чувствителен к тому или иному препарату, позволяет секвенирование нового поколения (NGS — next generation sequencing).
Если в результате исследований в клетках опухоли удаётся обнаружить мишень, для которой уже есть препараты, врач-химиотерапевт подбирает таргетную терапию и принимает решение, нужны ли дополнительные виды лечения, например химиотерапия.
Как проводится таргетная терапия
Таргетную терапию назначают как самостоятельное лечение, так и в качестве одного из компонентов комплексной терапии: препараты принимают до или после операции или совместно с курсом химиотерапии. Длительность курса зависит от вида рака и состояния пациента. Врач контролирует эффективность лечения и, если возникают серьёзные побочные эффекты или развивается устойчивость к терапии со стороны опухоли, стратегию терапии меняют.
Препараты принимают в виде таблеток или вводят в организм с помощью капельниц. В первом случае пациент лечится дома, получая препараты у онколога. Во втором случае ему придётся с определённой периодичностью посещать медучреждение или находиться в круглосуточном стационаре. Обычно введение капельницы занимает менее 2 часов и не требует специальной предварительной подготовки.
Таргетная терапия разных видов рака
Впервые таргетную терапию применили для лечения рака молочной железы. Сейчас она используется в терапии различных онкологических заболеваний.
Рак лёгких
У пациентов с немелкоклеточным раком лёгких в некоторых случаях заболевание ассоциировано с патологическими изменениями в генах EGFR, ALK, ROS1, BRAF, NTRK, MET, RET, HER2, KRAS. Чаще всего (примерно в 16% случаев немелкоклеточного рака лёгких) сталкиваются с мутацией гена EGFR. В этом случае могут назначить следующие препараты: эрлотиниб, гефитиниб, афатиниб, дакомитиниб, осимертиниб.
Рак молочной железы
В 20–30% случаев рак молочной железы связан с мутацией гена HER2/Neu. При HER2-позитивном раке молочной железы на поверхности раковых клеток вырабатывается избыточное количество белка-антигена, который становится мишенью для таргетных препаратов: трастузумаб, пертузумаб, лапатиниб, нератиниб и адотрастумумаб. В 5% случаев РМЖ ассоциирован с наследственными мутациями в генах BRCA1 и BRCA2. В этом случае врач может выбрать препараты олапариб, нирапариб, рукапариб, талазопариб, велипариб.
Рак толстой кишки
Около 10% случаев колоректального рака возникает из-за наследственных заболеваний и генетических мутаций. Традиционно при исследовании биопсийного материала проводят анализ на микросателлитную нестабильность (MSI), которая ассоциирована с наследственным синдромом Линча, и мутации в генах KRAS, NRAS, BRAF, HER2. Кроме того, учитывается локализация опухоли, так как этот параметр также влияет на выбор препаратов. При отсутствии мутаций используют цетуксимаб и панитумумаб в сочетании с химиотерапией. При наличии мутаций используют бевацизумаб.
Рак печени
90% случаев первичного рака печени составляет гепатоцеллюлярный рак, связанный с генетическими изменениями. Он малочувствителен к химиотерапии, зато хороший эффект во многих случаях даёт лечение таргетными препаратами, в первую очередь сорафенибом, а также ленватинибом, кабозантинибом, регорафенибом, рамуцирумабом, бевацизумабом.
Рак желудка
В 20% случаев при раке желудка обнаруживается мутация гена HER2. На эту мишень воздействуют препараты трастузумаб и дерукстекан, которые сдерживают развитие опухоли. Также при лечении рака желудка применяются препараты, которые блокируют рост новых сосудов, снабжающих опухоль питательными веществами. К ним относится, например, рамуцирумаб.
Рак поджелудочной железы
Таргетная терапия при раке поджелудочной железы применяется редко, так как генетические мишени для таргетной терапии удаётся обнаружить в 5–10% случаев. Это мутации в генах BRCA1 и BRCA2.
Рак почки
Основной препарат в лечении рака почки — темсиролимус (ингибитор пролиферативного сигнала mTOR). Этот препарат взаимодействует с белком mTOR, отвечающим за клеточный метаболизм, рост и деление клеток. Он позволяет замедлить рост самой опухоли и кровеносных сосудов, питающих её. Также для лечения рака почки применяют сунитиниб и бевацизумаб.
Меланома
В 60–70% случаев при меланоме выявляют мутации в гене BRAF. В таком случае для лечения заболевания могут назначить препараты дабрафениб, вемурафениб, траметиниб.
Недостатки таргетной терапии
Таргетная терапия — очень перспективный метод лечения онкологических заболеваний, но у неё есть свои недостатки.
Минусы таргетной терапии:
- развитие резистентности. Сначала опухоль может хорошо реагировать на препарат, но через некоторое время эффект ослабляется. Чтобы этого избежать, назначают комбинацию из двух таргетных препаратов или сочетают этот вид лечения с химиотерапией;
- ограниченность в применении. Таргетная терапия эффективна далеко не для всех пациентов. Она подходит только тем, у кого в раковых клетках есть соответствующие мишени, для которых уже существуют препараты. Для некоторых уже идентифицированных и распространённых мишеней до сих пор не создано лекарство, потому что его сложно разработать;
- дороговизна. Курс таргетного препарата стоит от нескольких десятков до нескольких сотен тысяч рублей. В России пациенты бесплатно получают препараты для лечения онкологических заболеваний в государственных организациях здравоохранения.
Несмотря на то что таргетная терапия менее токсична, чем химиотерапия, побочные эффекты всё же возникают
Пациенты, которые принимают таргетную терапию, сталкиваются с неприятными последствиями. Правда, большинство побочных эффектов проходят с окончанием лечения. Кроме того, есть лекарства, которые помогают облегчить многие неприятные симптомы.
Распространённые побочные эффекты таргетной терапии:
- диарея;
- тошнота и рвота;
- повышение артериального давления;
- зуд и сухость кожи и слизистых оболочек;
- ладонно-подошвенная эритема (припухлость и высыпания на ладонях и стопах);
- высыпания на коже и слизистых оболочках;
- головная боль;
- головокружение;
- анемия;
- ухудшение свёртываемости крови;
- изменение цвета и структуры волос;
- перфорация желудка или кишечника (очень редко).
Эффективность и перспективы таргетной терапии
Давать общую оценку эффективности таргетной терапии довольно сложно, так как этот показатель во многом зависит от препарата, вида рака и других параметров. Но существуют отдельные исследования, которые показывают, что этот вид терапии действительно позволяет успешно бороться с развитием заболевания. Например, в ходе клинического исследования пациентов с плоскоклеточным раком головы и шеи были получены следующие результаты.
В группе пациентов, которые получали таргетный препарат и химиотерапию, у 88% пациентов был выраженный положительный эффект от лечения, в том числе у 16% опухолевый процесс стабилизировался. В контрольной группе, где применяли только химиотерапию, у 46% пациентов наблюдалось прогрессирование опухоли — почти в 4 раза чаще, чем у пациентов из первой группы, а стабилизация опухолевого процесса наблюдалась только у 5,8% пациентов.
Таргетные препараты входят в схемы лечения многих видов онкологических заболеваний и дают выраженный противоопухолевый эффект. Они увеличивают срок жизни пациентов с метастатическим раком и заболеваниями, выявленными на поздней стадии. Ученые многих стран мира ищут новые мишени для лекарств от рака и разрабатывают более действенные препараты, которые дают надежду на ремиссию тысячам пациентов с онкологическими заболеваниями.
Источники
- Вельшер Л. З., Космынин А. А., Дудицкая Т. К. и др. Местнораспространённый рак орофарингеальной зоны: настоящие перспективы таргетной терапии // Злокачественные опухоли. 2013. № 1. С. 56–60.
- Герк И. А. История таргетной терапии // Практическая онкология. 2023. Т. 24. № 2. С. 119–144.
- Рак : информационный бюллетень / ВОЗ. 2022.
- Трякин А. А., Бесова Н. С., Волков Н. М. и др. Практические рекомендации по общим принципам проведения противоопухолевой лекарственной терапии // Злокачественные опухоли: практические рекомендации RUSSCO #3s2. 2022. Т. 12. С. 27–40.
- Kaur R., Bhardwaj A., Gupta S. Cancer treatment therapies: traditional to modern approaches to combat cancers // Mol Biol Rep. 2023. Vol. 50(11). P. 9663–9676. doi:10.1007/s11033-023-
08809-3 - Riedl J. M., Moik F., Esterl T., et al. Molecular diagnostics tailoring personalized cancer therapy-an oncologist’s view // Virchows Arch. 2024. Vol. 484(2). P. 169–179. doi:10.1007/s00428-023-03702-7
Частые вопросы
Таргетные препараты — современный метод лекарственного лечения рака. Они менее токсичны, чем химиотерапия, и часто более эффективны, но подходят не всем. Эти лекарства связываются с особыми белками, которые выделяют клетки опухоли, и воздействуют на них. Они уничтожают раковые клетки, замедляют их развитие или перекрывают новообразованию кровоснабжение. Такие мишени удаётся обнаружить не во всех раковых опухолях, а только в тех, чьи клетки имеют определённые генетические мутации.
Читать статью целикомврач-эксперт






